brake_pad_expert wrote:
很多專家都批評國產疫(恕刪)
還在帶過時、而且嚴重錯誤的風向!
已經不是可惡可以形容的

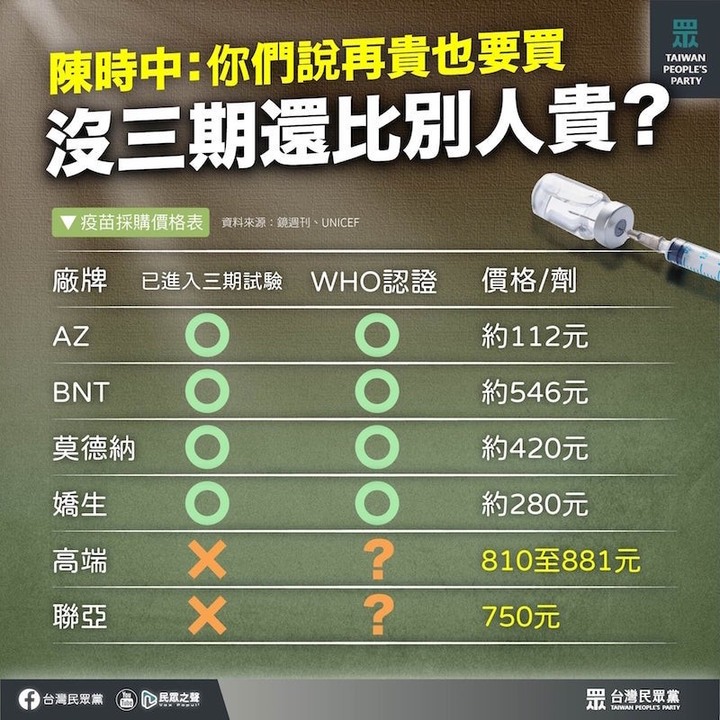
先講結論:這4支全球接受度最高、最受信賴的疫苗,都是在進行數萬人規模的第三期臨床試驗、期中報告(interim report)顯示安全性與有效性(保護力,efficacy)符合要求之後,才拿到歐美監管當局的「緊急使用授權」(EUA)或「有條件上市許可」(CMA)。換言之,對於疫苗上市,第三期試驗不可或缺。台灣要搞特例(譬如以擴大二期充當三期)就大大方方開誠布公,不宜以錯、假訊息來挾洋自重。
一、二期臨床試驗與第三期天差地遠
新研發的藥物、醫療裝置、治療方法在上市前都要進行嚴謹的臨床試驗,以充分證實其安全性與有效性,疫苗當然不例外。第一期主要是評估疫苗之於人體的安全性與劑量耐受性;此外也會收集初步的「免疫原性」(immunogenicity,免疫系統對特定抗原產生免疫反應)資料。第二期進一步測試疫苗安全性與免疫原性,找出最適劑量、投予方式與時程;此外也會收集疫苗療效的初步資料。第三期將確認疫苗的有效性與安全性。
第三期最為關鍵,足以決定疫苗的成敗命運,規模遠大於第一期(數十人)與第二期(數百人),受試者可能多達數千人甚至數萬人,時間可能長達數年;對於傳染病,必須經過至少兩個流行季。由於新冠肺炎疫情緊迫,因此監管機構去年很快就達成共識,大幅縮短第三期試驗的時程,但「縮短」絕對不等於「省略」。
「緊急使用授權」與「有條件上市許可」
這就要談到美國監管當局的「緊急使用授權」(EUA)與歐洲的「有條件上市許可」(CMA)。兩種程序都是因應疫情而為疫苗開出的方便門與快車道,但絕非旁門左道,美國食品藥物管理署(FDA)明文規定:「資料安全監控委員會(DSMB)評估來自第三期臨床試驗的數據,並就疫苗是否已滿足FDA設定的臨床終點標準(clinical endpoint),向疫苗製造商提供建議。」
歐洲藥品管理局(EMA)的規定多一點彈性,容許申請CMA的藥廠「在安全性許可的前提下,合併不同階段的臨床試驗」,但「合併」也絕對不等於「省略」,而且上述5大藥廠的4支疫苗,全都是先規規矩矩進行第三期試驗、拿到有效性符合要求的初步資料,再向監管當局申請EUA或CMA。
5大藥廠的4支疫苗的上市之旅
新冠疫情肆虐全球,唯二能達成群體免疫(herd immunity)的途徑除了病毒感染,就是疫苗接種,吾人當然希望走第二條路,因此疫苗研發舉世矚目,藥廠也盡可能將研發、申請與生產進程攤在陽光下,第三期試驗的相關資訊一目瞭然,容不得台灣的政客與名嘴睜眼說瞎話
====== ====== ====== ======
輝瑞/BioNTech疫苗「BNT162b2」(商品名COMIRNATY、復必泰)
2020年7月27日──展開第三期試驗,召募4萬3538名受試者。
11月8日──3萬8955名受試者完成注射第二劑。
11月9日──公布第三期試驗第一份初期報告。
11月18日──第三期試驗研究報告顯示,疫苗有效性達95%。
11月20日──根據第三期試驗結果,向美國FDA申請EUA。
12月2日──獲得英國政府藥物及保健產品管理局(MHRA)核准EUA。
12月10日──在《新英格蘭醫學期刊》(NEJM)發表第三期試驗結果。相關資料提交各國監管單位。
12月11日──獲美國FDA核准EUA。
12月21日──獲歐盟核准CMA。
====== ====== ====== ======
莫德納(Moderna)疫苗「mRNA-1273」
2020年7月27日──展開 第三期「冠狀病毒有效性」(COVE)臨床試驗,召募約3萬名受試者。
10月14日──向歐盟EMA提交「上市許可申請」(MAA)。
10月22日──完成第三期試驗第2劑疫苗注射。
10月27日──接受英國MHRA滾動式審查(rolling review)。
11月16 日──第三期試驗有效性數據出爐:94.5%。
11月17日──接受歐盟EMA滾動式審查。
11月30日──公布第三期試驗有效性研究報告,向美國FDA申請EUA。
12月18日──獲美國FDA核准EUA。
12月31日──在NEJM發表第三期試驗報告。
2021年1月6日──獲歐盟核准CMA。
====== ====== ====== ======
阿斯特捷利康(AstraZeneca)疫苗「AZD1222」(商品名Vaxzevria、Covishield)
2020年8月31日──展開美國地區第三期試驗,其他試驗國家包括日本、俄羅斯、南非、肯亞、拉丁美洲。
11月23日──第三期試驗期中報告出爐,兩種劑量的有效性分別為90%、62%。根據相關資料,向各國監管單位申請EUA或CMA。
12月8日──第三期試驗期中報告發表於《刺胳針》(The Lancet)。
12月30日──向歐盟EMA申請CMA。
12月30日──英國 MHRA根據第三期試驗報告核准EUA。
2021年1月29日──獲歐盟EMA核准CMA。
====== ====== ====== ======
嬌生(Johnson & Johnson)疫苗「Ad26.COV2.S」
2020年9月23日──第三期試驗開始。
12月17日──第三期試驗完成召募,約4萬5000人參與。
2021年1月29日──第三期試驗期中報告顯示, 有效性為72%(美國)、66%(全球)。
2月4日──根據第三期試驗結果向美國FDA申請EUA。
2月16日──向歐盟EMA提出MAA。
2月27日──獲美國FDA核准EUA。
3月11日──獲歐盟核准EMA。
brake_pad_expert wrote:
你提供的這些資料,沒有一家已經作完三期,每一家都是臨床三期的期中而已,
請問你可以告訴我,有哪一家藥廠"已經完成"臨床三期了?
你硬要玩文字遊戲也沒問題,
的確,現下沒有任何一個上市的疫苗已經"完成"臨床三期,
不過人家至少都有三期期中數據,
其中最差,常被綠腦拿出來說嘴的有效力50%科興也都通過WHO緊急授權,
這些疫苗都已經接種過上億人口,其有效性或是副作用也都有底了,
請問一下高端到底擁有上述那些條件非要人去接種這個疫苗不可?
沒通過WHO緊急授權就甭談了,至少學人家先給出三期期中報告再說,
有效性多少?接種上百萬人後會多少機率出現嚴重副作用?
別說到最後只剩下"土產"的信仰而已。