疫苗不足 ,就是使用 Ivermectin
結果 和 WHO 預測的相反
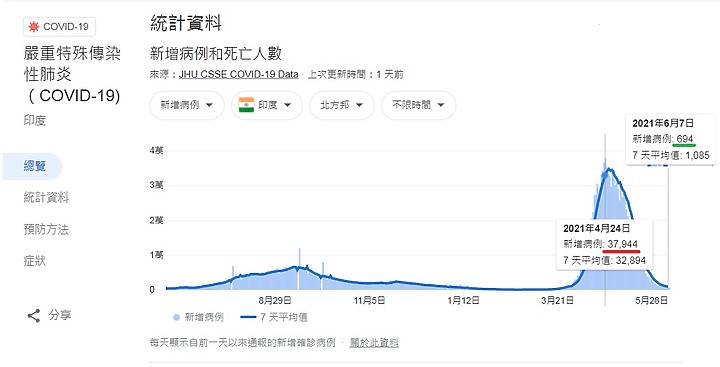
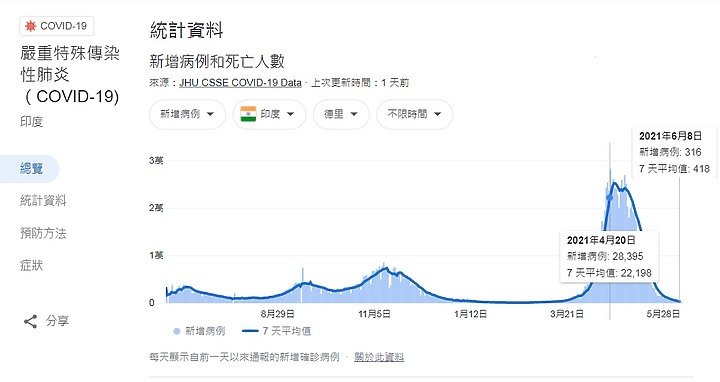
印度 德里 由 4月20日 , 每日新增病例 28394 降到 6月8日每日316例
總部位於孟買的印度律師協會((IBA) 向 WHO世界衛生組織首席科學家(Chief Scientist)、日內瓦的 Soumya Swaminathan 博士送達了一份長達 51 頁的法律通知(legal note),因為她反對使用伊維菌素治療 Covid 患者。
律師協會 在說明書中威脅 , “根據 IPC 的第 302、304 (II)、88、120 (B) 和 34 條以及 IPC 的其他規定以及 2005 年災害管理法,對於在印度的每起因此而導致的死亡,對你的作為和不作為的行為 , 將在具有管轄權的適當法院起訴她”。
認為她忽略有意義的科學證據,散播不實資訊、意圖讓印度人民不配合政府為抑制新冠肺炎疫情廣泛發放 ivermectin口服 的公衛行動。
印度醫學研究委員會 (ICMR) 和德里全印度醫學科學研究所 (AIIMS) 公開反對她的立場,違抗WHO更新於 2021 年 5 月 17 日的“國家 COVID-19 管理指南”。並保留了對“症狀輕微的患者和那些居家隔離者”使用伊維菌素Ivermectin的建議 。
為了阻止 Soumya Swaminathan 博士對該國公民的生活造成進一步損害,IBA 已決定對她提起法律訴訟,並在此過程中向她發出了法律通知。
這表示印度官方公然違抗WHO阻止散發ivermectin的指示,也表示印度政府肯定ivermectin的療效。
台灣每天幾百例新增病例 ? 每天 20 幾人死亡
第三世界國家 , 卻使用了便宜而且容易取得的 預防性藥物
ivermectin/doxycycline/azithromycin 抗病毒藥 , 壓低了 死亡率
當然以台灣醫療的自傲? 是看不起這種第三世界 簡單 快速 又便宜 的做法
台灣只是送隔離 , 完全沒有給 預防性藥物
https://ivmmeta.com/
越早投藥 , 死亡率會越低
prophylaxis treatment
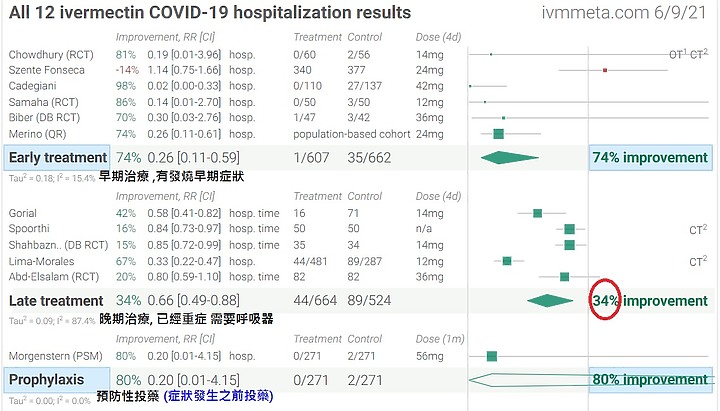
參考文獻 1
Available Compounds With Therapeutic Potential Against COVID-19: Antimicrobial Therapies, Supportive Care, and Probable Vaccines
對 COVID-19 具有治療潛力的可用化合物:抗菌療法、支持性護理和可能的疫苗
下圖: SARS-CoV-2 的生命週期及其可能的抑製劑。SARS-CoV-2的S 蛋白與由絲氨酸蛋白酶 TMPRSS2 引發的細胞的血管緊張素轉化酶 2 (ACE2) 結合。
病毒 RNA 在細胞質中出現以產生 PP1a 和 PP1ab 多蛋白,它們被切割形成非結構蛋白。
這些非結構蛋白通過複製和轉錄過程促進負股 RNA 的形成。這反過來又轉化為 N 蛋白。
另一組翻譯進入內質網-ERGIC-高爾基體以產生結構蛋白(S、M 和 E)。
最後,用 N 蛋白包裝病毒 RNA 並進一步組裝 S、M 和 E 蛋白,出芽形成 SARS-CoV-2 ,通過胞吐作用從受感染的細胞中釋放出來。
顯示在不同階段抑制 SARS-CoV-2 的各種藥物是 CQ/HCQ, Chloroquine氯喹//Hydroxychloroquine羥氯喹; ;L, Lopinavir洛匹那韋;R1,Ritonavir利托那韋;I, Ivermectin;伊維菌素;R,Remdesivir瑞德西韋,R2,Resveratro白藜蘆醇;D,Darunavir達蘆那韋;C,Camostat卡莫司他; ;F, Favipiravir法拉匹韋。
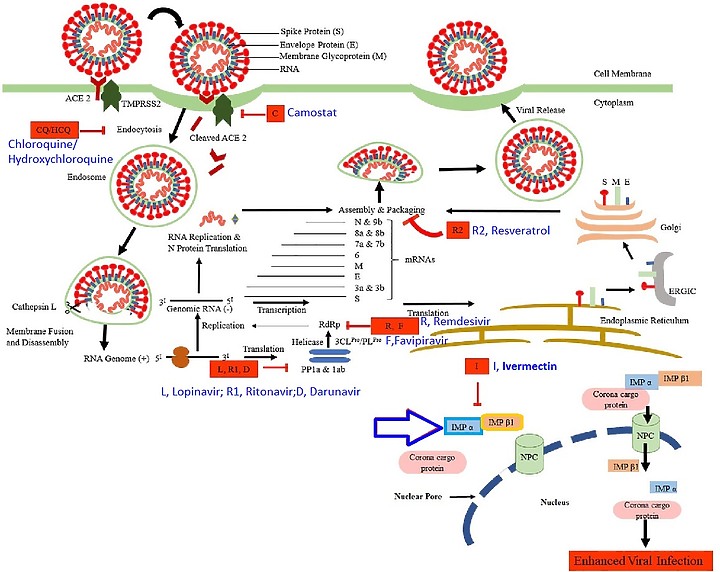
其它藥物都在病毒複製的階段加以阻斷, 伊維菌素 Ivermectin涉及 IMPα/β1 的病毒核衣殼蛋白的信號依賴性核質關閉(Timani,2005;Wulan ,2015)。STAT1 轉錄因子的抗病毒活性被 SARS-CoV 輔助蛋白 ORF6 阻斷,導致 IMPα/β1 隔離在粗面內質網/高爾基體膜上
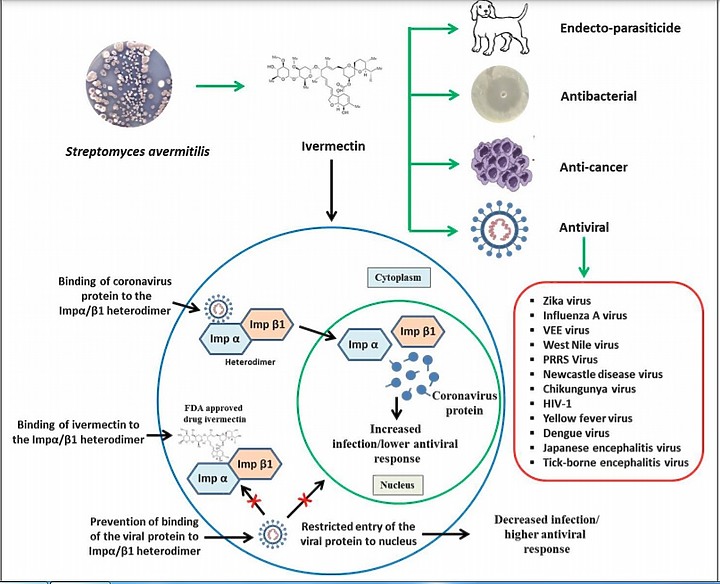
參考文獻2
Ivermectin, a new candidate therapeutic
against SARS-CoV-2/COVID-19
伊維菌素,一種針對 SARS-CoV-2/COVID-19 的新候選療法
伊維菌素Ivermectin的抗 SARS-CoV-2 作用涉及伊維菌素Ivermectin先與 Impα/β1 異源二聚體的結合,導致其不穩定並阻止 Impα/β1 與病毒蛋白的結合。這樣可以防止SARS-CoV-2病毒的蛋白進入細胞核,導致有效的抗病毒反應
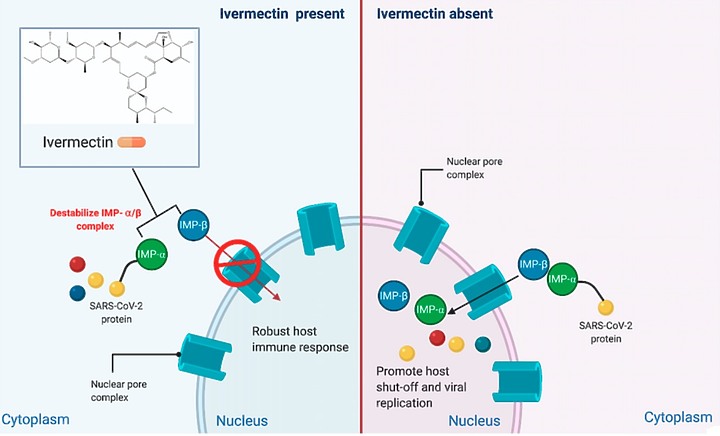
依維菌素 Ivermectin 無法防止病毒複製 , 只是擋住病毒蛋白進入靶細胞的細胞核 , 這樣可以降低死亡率