為何2021年的5月14日,18位國際科學家共同在權威雜誌《科學Science》雜誌上發表聯署公開信,呼籲對病毒溯源重新進行評估,認為之前的溯源工作並未對病毒來自“實驗室泄露”的可能性給予足夠的關注。
因為科學界一直找不到能支持"病毒自然出現"的證據。
當發現棄嬰時,能依據DNA找到父母。
這個棄嬰病毒有RNA序列排序29903鹼基來比對 , 有96%最相似的是RaTG13,
RaTG13最初並沒有向基因銀行通報 , 而是在許多中國的博碩士論文中描述提及(當時稱為BtCoV / 4991)
再比對這個引發 Covid-19的病毒 SARS CoV-2 的其它親戚在那裏 ?
全都在中國

雖然來自蝙蝠的冠狀RaTG13病毒,比對出和Covid-19的SARS-2冠毒 有96%相似 , 但是在S蛋白RBD區的相似度卻不如另外一種在廣東穿山甲發現的冠毒MP789 ?
一個自然演化的蝙蝠冠毒?要如何和穿山甲冠毒自然雜交在一起?
分析這個SARS-CoV-2病毒的基因組成, 是以 96%都相同的 蝙蝠RaTG13病毒為骨幹, 換上穿山甲MP789病毒之 Spike 蛋白 , 在MP789的S蛋白上再改造,插入PRRA能引入弗林Furin蛋白酶 , 以及置換帶有正電荷

這是經過多次重組之嵌合病毒
這個引發COVID-19的SARS-CoV-2病毒有5個奇怪特徵 ,很難以自然演化或突變來解釋
(1)它的基因序列有其它冠狀病毒都沒有 PRRA 的插入 ?
SARS-2 在 S1/S2 連接處, 在681-PRRA-684 位點, 有12 個核苷酸(4個氨基酸)的插入片段,引入弗林Furin蛋白。
CGGCGG 插入片段包括一個Fau I 限制性位點 。
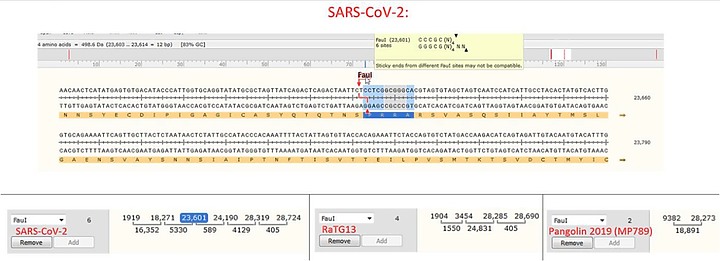
Restriction Endonucleases
CCCGC(N)4▼
GGGCG(N)6▲
其它β CoV 冠狀病毒是完全沒有 PRRA , 完全沒有Furin弗林蛋白酶, 這個Furin那裏來的?

與 MP789 和 RaTG13 序列相比,SARS-CoV-2 中弗林蛋白酶裂解位點的插入PRRA與序列的其餘部分不在同框內。因此,排除這種插入可能源於聚合酶滑動或釋放和重新引發,因為這些機制產生的插入突變仍會維持病毒序列的閱讀框ORF(不含終止密碼子)。
引入弗林Furin蛋白酶,能將S蛋白切開成S1/S2兩個亞基。由於S1嵌入後需要宿主細胞的"酶"切開,露出S2去溶解細胞膜,能引入弗林Furin蛋白酶可以加速感染 。
每個氨基酸由3個鹼基指定, 四個PRRA的插入冒出來? 一次產生12個突變?正好組成PRRA引入弗林蛋白酶? 這個機率是10億分之1
(2)以CGG插入? CGG 指定 精氨酸(Arginine ,R) 是冠狀病毒最不愛卻是人類最愛 ?
我們知道三個鹼基可以組成密碼子,去指定一種氨基酸
精氨酸(Arg/R) 可以 CGU CGC CGA CGG AGA AGG 等6種方式來指定
但是每一種動物喜好的密碼子指定方式不同
在681-PRRA-684 位點的插入序列是 T-CCT-CGG-CGG-GC。CCT 編碼脯氨酸,兩個 CGG 編碼兩個精氨酸,GC 是編碼丙氨酸的 GCA 密碼子的開頭。
這個插入片段有幾個奇怪的特徵,但最奇怪的是兩個並排的 CGG 密碼子。
SARS2的精氨酸密碼子中只有5%是CGG,在其他任何β冠狀病毒中都沒有發現雙密碼子CGG-CGG。但是 CGG卻是人類最常指定精氨酸(Arg/R)的方式?
如果是冠狀病毒的自然突變?編碼方式卻是冠狀病毒極少出現的編碼方式?
那麼SARS2是如何獲得一對受人類細胞青睞但不受冠狀病毒青睞的精氨酸密碼子呢?以CGG編碼在冠毒只有5%,此處不但出現還重覆出現2次?自然發生的機率有多少?
(3)對蝙輻細胞的感染力弱? 親和力只有對人類細胞的1/10
如果 SARS2 一躍從蝙蝠跳到人身上並且此後沒有太大變化,它應該仍然擅長感染蝙蝠。但似乎不是。
“經過測試的13種蝙蝠, 只有其中2種蝙蝠能被 SARS-CoV-2 感染,而且病毒對蝙蝠細胞的結合能力? 親合力只有對人類細胞的1/10 ? 因此它們不太可能成為人類感染的直接來源,也沒有找到那一個蝙蝠族群是 Covid-19(SARS-CoV-2病毒)的保毒者 ?
(4)找不到中間宿主 ?
雖然 , 自然界病毒不只是一次從一個物種跳到另一個物種。
適應攻擊蝙蝠細胞的冠狀病毒刺突蛋白需要反復跳轉殖到另外一個物種,其中大部份失敗,然後才能獲得幸運突變。突變→其中一個 RNA 單位的變化→導致不同的氨基酸單位被納入其刺突蛋白,並使刺突蛋白能夠更好地攻擊其他物種的細胞。
通過更多這樣的突變驅動調整,病毒適應了它的新宿主,比如蝙蝠經常接觸的一些動物。整個過程不斷重複 ,隨後病毒從這個中間宿主轉移到人體身上。
就 SARS1 而言,研究人員記錄了隨著病毒逐步進化為危險病原體時其刺突蛋白的連續變化。在它從蝙蝠轉變成果子狸之後,在它成為人類的溫和病原體之前,它的刺突蛋白發生了六次進一步的變化。再經過 14 次變化後,該病毒更適合人類,並且隨著再發生 4 次變化,傳染病開始流行。
所以, 能在 果子狸身上及周邊環境找到 SARS1, 並紀錄到變化 。
同樣 , MERS 在駱駝身上及周邊環境中找到 , 並紀錄到變化。
SARS1 和 MERS 病毒都在環境中留下了大量痕跡。SARS1 的中間宿主物種在疫情爆發後的 4 個月內被確定,而 MERS 的宿主則是在 9 個月內確定的。然而,在 SARS2 大流行開始大約 15 個月後,經過大概密集的搜索,中國研究人員既沒有找到原始蝙蝠種群,也沒有找到 SARS2 可能跳入的中間物種,也沒有找到任何中國種群的血清學證據,包括武漢人在 2019 年 12 月之前曾接觸過該病毒。一年多來絲毫沒有獲得支持"病毒自然出現"的證據。
SARS2 自首次出現在人類身上以來一直沒有多樣性改變→它並非不需要,而是因為它已經非常適應人體細胞。
SARS2 基因組的統一結構暗示沒有任何通過中間動物宿主的跡象,自然界中也沒有發現有這樣的宿主。
(5)S蛋白被插入4個帶正電荷的氨基酸 , 正電會互斥 , 自然形成會跳開無法排在一起 ? 4個帶正電荷的氨基酸放在一起的冠狀病毒是絕無僅有
SARS-1 的 E341 (負電)R342K343K344I345(中性) ,因為有 E341帶負電 , SARS1實際上只有二個正電荷的表現
中國送交基因銀行的 Wuhan-hu-1武漢-滬-1號病毒 排序, 登錄在GenBank: 編號 MN908947.3
354-357就是 RRKR ←就是4個帶正電

SARS-1 E341 R342 K343 K344 I345 →SARS-2 354R355R356K357R
查了很多篇報告所描述的序列 , 是 354N355R356K357R , 由SARS1的 ERKR →SARS 2 的NRKR 這涉及兩個位點的改變 Glu(E)354Asn(N) 及 Lys(K)357 Arg(R)
354由SARS1 的麩胺酸(glutamic acid) 帶負電 , 轉變為SARS-2的天門冬醯酸(Asparagine)N取代後轉變為中性, 這個 N354在 △ E為負值<0 , 表示有可以做功的能量 , 加上R355 K356 R357 當然讓整體 帶正電的情況改變

這個S蛋白帶"正電荷"的改變 , 完全超出免疫系統現有防禦功能, 能逃脫抗體 綑綁 , 帶電黏上來感染
其重要性是 造成 『突破性感染』
打疫苗產生的抗體能因"靜電吸附"而逃脫, 擋不住病毒侵入 , 只能等侵入後讓 T細胞出來清除 ,也就是, 病毒無法靠疫苗去產生液遞免疫的抗體而阻絕境外擋在細胞外, 一定會造成感染,讓PCR驗到陽性。只能在被感染之後, 靠第二道防線, 活化T細胞清除掉病毒。
能全部都說成這是 "自然突變"所造成的 ? 這麼巧這麼多突變約定好一起進行 ?
SARS-2 雖然在全序列和 RaTG13 有96%一致 , 但是在 RBD區卻相差很大
但從 廣東 穿山甲中分離的 MP789 穿山甲株與 SARS-CoV-2 的 RBD 幾乎相同。
穿山甲 CoV 和 SARS-CoV-2 在 RBD 的五個關鍵殘基上具有相同的氨基酸,而 RaTG13 與 SARS-CoV-2 僅共享一個氨基酸
顯然, SARS-2 就是個組裝在一起的病毒 , 可以通過以RaTG13 為骨架 , 再裝上 MP789 的 RBD 區
若要自然發生, 這兩種病毒必須同時感染同一生物體中的同一細胞,但是RaTG13 的受體結合研究表明,它的S蛋白不與穿山甲 ACE2 受體結合。
這樣要如何自然發生?????
2021年的5月14日,十八位國際科學家共同在權威雜誌《科學Science》雜誌上發表聯署公開信,呼籲對病毒溯源重新進行評估,認為之前的溯源工作並未對病毒來自“實驗室泄露”的可能性給予足夠的關注。參與連署的頂尖級病毒學家中就包括曾與武漢病毒研究所緊密合作的美國科學家北卡羅來納大學病毒學家拉爾夫 巴里克(Ralph Baric),巴里克教授也因此而成為來自中國的網路攻擊的目標。































































































