這政府是?強打無用疫苗三劑只會死更多人
防不了傳染後騙說防重症!
美國加州的數據,打疫苗的重症率是天然免疫者的3倍,這在暗示什麼?在展現:打疫苗後,讓人產生更多的抗體,反而增強了病毒的活力!病毒的絕技ADE來了,抗體成了病毒的幫凶——如此看來,疫苗和抗體的自救,反而成了推手……
程伯老師 wrote:
我有個疑問 雖然病毒(恕刪)
不活化疫苗的抗原沒有特殊處理
但是SARS-2病毒的S蛋白有不同的構象
任職於美國德克薩斯大學奧斯汀分校的Jason McLellan教授,此前在美國國立衛生研究院(NIH)下屬的疫苗研究中心從事博士後研究時,發現呼吸道合胞病毒(RSV)存在著類似的表面蛋白構象轉換問題。他與合作者Barney Graham博士在分析病毒表面蛋白結構的基礎上發現,在蛋白質的氨基酸序列中引入若干突變可以穩定融合前構象。穩定後的融合前構象能夠引發強烈的免疫應答,從而為研發RSV疫苗指明方向。
SARS-2病毒有同樣的現象,其S蛋白有open及close兩種構象:融合前的蛋白和進入人體,和細胞受體融合後蛋白構象亦不同

用融合前S蛋白做疫苗抗原,刺激出相對的抗體。以插頭和插座來解釋, 產生的抗體(如同插頭保護蓋)與融合前S蛋白(插頭)特異性嵌合,可以理解為抗體把融合前S蛋白捆綁住了,病毒就不能用該S蛋白(插頭)與細胞ACE2受體(插座)融合,避免細胞被感染。
如果用融合後S蛋白做為疫苗抗原,所產生的抗體只認識融合後S蛋白,很可能難以識別融合前S蛋白,也就不能阻斷病毒與細胞的融合
https://www.proteobiojournal.com/articles/apb-aid1014.pdf
The SARS CoV-2 spike domain, RGD and integrin binding eff ectrelationship for vaccine design
strategy
這一篇有說明
明明就是拿融合前S蛋白做疫苗抗原, 又沒有和人體細胞結合,如何會變成融合後S蛋白?
SARS-2的S蛋白是所有冠狀病毒中最不穩定,即便不與人體細胞結合,但這個病毒刺突蛋白 S1-S2 邊界處獨特的“RRAR”弗林蛋白酶切割位點, 681-PRRA-684位點的插入 , 引入了Furin弗林蛋白酶, 切開S1和S2, 就會出現【融合前→融合後】蛻變。
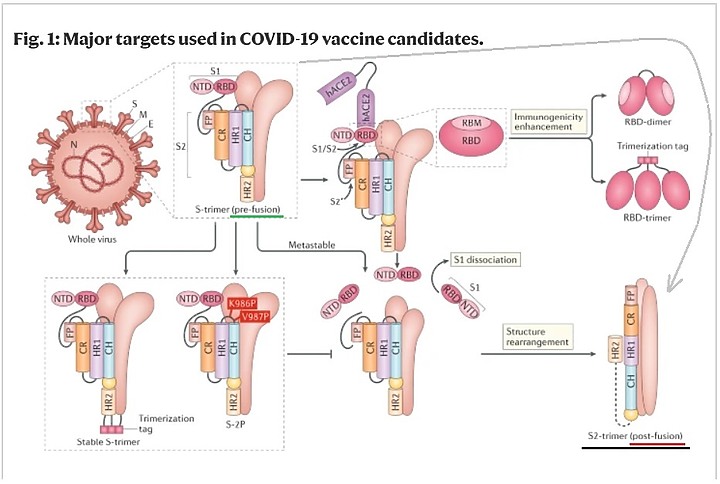
然而,S1 亞基是 CoV 感染期間的免疫優勢抗原,因為它可用於免疫識別,並且它主要在其 RBD 上包含中和表位。將 S 蛋白穩定在其融合前構象和增強融合前 S 蛋白表達,可以提高疫苗誘導的針對 S1 亞基上的抗體
對於不活化(滅活)疫苗和重組S蛋白疫苗,剛生產出來時的抗原以融合前S蛋白為主,但裝入疫苗瓶後隨著時間的變化,不穩定的S蛋白可能會慢慢蛻變成了融合後S蛋白,疫苗的效果會打折扣。
要讓S蛋白穩定, 需要改造S蛋白
帕勒森Pallesen等人的報告,說明了中心螺旋和 HR1 頂端的兩個脯氨酸取代(2P),可以將 MERS-CoV、SARS-CoV 和 HKU1 的 S 蛋白保留在抗原性最佳的融合前構象中。由此產生的抗原 S-2P 在小鼠中誘導的 nAb 效價比野生型 S 蛋白高得多。從之前使用這些 CoV 的經驗中學習,S-2P 設計現在被用於針對 COVID-19 的幾種疫苗策略。
就是在S蛋白的胺基酸序列986-987位置插入了2個脯氨酸(Proline),成功地穩定住了融合前S蛋白。這種改造後的S蛋白,被稱為S-2p抗原。
融合前的 S 蛋白在體外製備過程中通常是次穩態的,並且易於轉化為其融合後的構象。兩個殘基(K986 和 V987)突變為脯氨酸可穩定 S 蛋白 (S-2P) 並防止融合前到融合後的結構變化。
這項S蛋白改造術在美國申請了專利,美國國立衛生研究院(NIH)負責對外授權使用該專利。目前,BioNTech/輝瑞,強生,Novavax,CureVac後來都使用該專利改善自己的COVID-19疫苗抗原設計,Morderna公司因為與NIH一直有合作,對冠狀病毒S蛋白的特性比較了解,所以一開始就用了S-2p蛋白。台灣的高端同樣一開始就使用這種抗原。
理論上,體內生產的病毒載體疫苗或核酸疫苗,不需要擔心S蛋白蛻變問題,但實際研究發現這些疫苗用S-2p蛋白替代S蛋白,免疫原性確實更好,
而不活化疫苗就算換了不同的病毒株,同樣無法讓S蛋白穩定,這個病毒的681-PRRA-684位點插入,能引進弗林蛋白酶,切開S1亞基,而S1嵌入ACE2受體,是抗原識別最重要的蛋白


































































































